
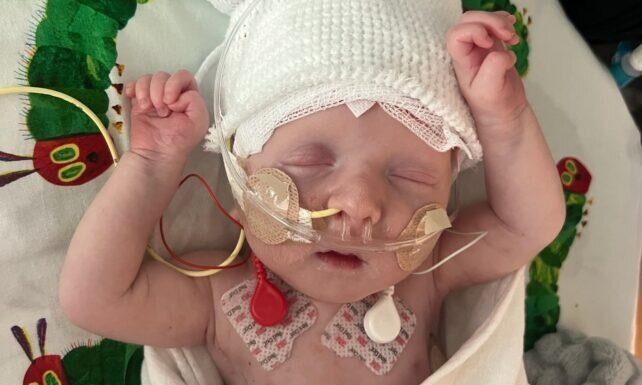
پزشکان با استفاده از نخستین درمان ویرایش ژن شخصیسازیشده در جهان یک پسر ۹ و نیم ماهه مبتلا به یک بیماری نادر ژنتیکی را علاج کردند. شیوهای که برای علاج این نوزاد پسر به کار رفت، بالقوه میتواند به افراد مبتلا به هزاران بیماری ژنتیکی غیر معمول هم کمک کند.
کایل و نیکول مالدون از همان ابتدای به دنیا آمدن «کیجی»، نوزاد پسرشان متوجه شدند که او دچار مشکلی جدی است. پزشکان حدس میزدند که اودچار مننژیت (عفونت پردههای پوشاننده مغز) یا سپسیس (عفونت خونی) است.
هنگامی که کیجی فقط یک هفته از عمرش میگذشت، معلوم شد که دچار یک اختلال ژنتیکی نادر به نام کمبود CPS1 (کمبود آنزیم کارنیتین پالمیتوئیلترانسفراز یک) است که از هر ۱.۳ میلیون نوزاد، فقط یک نفر ممکن است دچار آن شود. اگر کیجی زنده میماند، دچار تاخیر شدید ذهنی و رشدی میشد و در نهایت به پیوند کبد نیاز داشت. اما نیمی از نوزادان مبتلا به این اختلال در هفته اول زندگی میمیرند.
پزشکان بیمارستان کودکان فیلادلفیا به خانواده مولدون پیشنهاد کردند با توجه پیشآگهی وخیم بیماری از درمانهای تهاجمی نوزادشان صرفنظر کنند و فقط مراقبتهای تسکینی را برای او انجام دهند.
خانم مولدون گفت: «ما او را دوست داشتیم و نمیخواستیم رنج بکشد.» اما او و همسرش تصمیم گرفتند به کیجی فرصتی برای ادامه زندگی دهند.
اما اکنون کیجی تاریخساز شده است. این نوزاد که اکنون ۹ و نیم ماهه است، به گفته پزشکانش، نخستین بیمار در هر سنی در جهان است که با شیوه ویرایش ژنی سفارشی ((custom gene editing درمان شده است. او دارویی تزریقی را دریافت کرد که مخصوص او ساخته شده بود و برای اصلاح دقیق جهش ژنی او طراحی شده بود.
پژوهشگرانی که رهبری اقدامات برای نجات کیجی را بر عهده داشتند، این هفته نتایج کار خود را در نشست سالانه «انجمن ژن و سلول درمانی آمریکاَ» ارائه میدهند و همچنین آن را در ژورنال پزشکی نیوانگلند منتشر میکنند.
کارشناسان میگویند پیامدهای این درمان فراتر از مورد کیجی است. بیش از 30 میلیون نفر در آمریکا به یکی از بیش از 7000 بیماری ژنتیکی نادر مبتلا هستند. اکثر این بیماریها آنقدر نادر هستند که هیچ شرکتی حاضر نیست سالها برای ایجاد ژندرمانی صرف هزینه کند که افراد بسیار کمی به آن نیاز داشته باشند.
اما شیوه درمانی مورد استفاده برای کیجی که بر اساس دهها سال پژوهش با بودجههای دولتی است، این امکان را برای شرکتها فراهم میکند تا بدون گذراندن سالها تولید و آزمایش پرهزینه، درمانهایی شخصیسازیشده را به وجود آورند.
ابزاری مولکولی برای درمان یک اختلال ژنتیکی نادر
بیماریهایی مانند بیماری کیجی نتیجه یک جهش واحد هستند - یک حرف DNA نادرست در میان سه میلیارد حرف در ژنوم انسان. اصلاح آن نیاز به هدفگیری دقیق در رویکردی به نام «ویرایش باز» (base editing) دارند.
در این روش ابزارهای مولکولی درمانی در مولکولهای لیپیدی (چربی) پیچیده میشود تا تا از تخریب آن در خون در مسیر رسیدن به کبد، جایی که ویرایش ژنی انجام میشود، جلوگیری شود. درون این محفظه لیپیدی دستورالعملهایی وجود دارد که به سلولها دستور میدهد تا آنزیمی تولید کنند که ژن را ویرایش میکند. این ذرات لیپیدی همچنین یک جیپیاس مولکولی به نام کریسپر (CRISPR) - را حمل میکنند که برای خزیدن در امتداد DNA فرد تغییر داده شده است تا حرف DNA دقیقی را که باید تغییر کند، پیدا کند.
اگرچه درمان ساختهشده برای این نوزاد طوری سفارشیسازی شده بود تا کریسپر فقط جهش خاص او را پیدا کند، اما همین روش میتواند بارها و بارها برای اصلاح جهشها در سایر نقاط DNA برای بیماریهای دیگر هم مورد استفاده قرار گیرد. فقط کافی است دستورالعملهای کریسپر که ویرایشگر را به نقطهای از DNA که جهش دارد هدایت میکند، تغییر پیدا کند.
دانشمندان پیشبینیمیکنند این شیوه در آینده بسیار ارزانتر شود و آن را یکی از فناوریهای بالقوه متحولکننده پزشکی میدانند.
داستان درمان ویرایش ژن سفارشی کیجی از عصر ۸ آگوست (۱۷ مرداد) آغاز شد، زمانی که دکتر کیران موسونورو، محقق ویرایش ژن در دانشگاه پنسیلوانیا، ایمیلی از دکتر ربکا آرنس-نیکلاس در بیمارستان کودکان فیلادلفیا دریافت کرد. نوزادی متولد شده بود و آزمایش ژنتیک نشان میداد که او دچار کمبود CPS1 است
همکاری گروهی برای نجات جان یک نوزاد
دکتر موسونورو شروع به بررسی استفاده از ویرایش ژن برای جهشهای ژنی نسبتاً رایج کرده بود.
ساختن یک ویرایشگر ژن برای درمان بیماران یک فرآیند هدفمند است که تکمیل شدن آن میتواند سالها طول بکشد. اما این نوزاد سالها وقت برای انتظار کشیدن نداشت – او قبل از اینکه دچار خطر فزاینده آسیب شدید مغزی یا مرگ شود، فقط شش ماه وقت داشت.
بیماری کیجی ناشی از ناتوانی در خلاص شدن بدن از آمونیاک، یک محصول جانبی سوختوساز پروتئین، است. آمونیاک در خون تجمع مییابد و به مغز میرسد و به آن آسیب میزند.. پزشکان به او یک رژیم غذایی با محدودیت شدید پروتئین دادند و فقط به اندازهای پروتئین به او دادند که برای رشدش کافی باشد. او همچنین دارویی به نام گلیسرول فنیل بوتیرات دریافت میکرد که به حذف آمونیاک از خونش کمک میکرد. اما او هنوز در معرض خطر بالای آسیب مغزی یا مرگ بود. هرگونه بیماری یا عفونت میتوانست میزان آمونیاک خون او را افزایش دهد و آسیب جبرانناپذیری به مغزش وارد کند.
کیجی در بیمارستان تحت مراقبت ۲۴ ساعته زندگی میکرد.
ساخت یک سیستم ویرایش ژن برای نوزاد مولدونها و آزمایش آن آسان نبود. اما با مشارکت دهها پژوهشگر که کارهای دیگرشان را کنار گذاشتند و همکاری چند شرکت زیستفناوری و تسهیل روند نظارت دارویی بوسیله سازمان غذا و داروی آمریکا (افدیای) ساختن یک ویرایشگر ژنی از نوع کریسپر با سرعت حیرتآوری انجام شد. کاری در شرایط معمول بیش از یک دهه به طول میانجامید، چند ماه انجام شد.
دکتر موسونورو با فئودور اورنف در دانشگاه کالیفرنیا، برکلی شروع به همکاری کرد که اطمینان حاصل کرد هیچ ویرایش ژنی غیرمنتظره و مضری در جای دیگری از DNA وجود ندارد. دکتر اورنف جزئی از یک همکاری دانشگاهی با شرکت داناهر بود که قادر به تولید ویرایشگر ژن برای این نوزاد با استانداردی بود که امکان استفاده از آن را در یک بیمار فراهم میکند.
صادق قاسم، مدیر ارشد فناوری داروهای ژنومی شرکت داناهر، گفت که این شرکت به نوبه خود با دو شرکت دیگر متعلق به خود، دو شرکت بیوتکنولوژی دیگر و یک موسسه تحقیقاتی دیگر همکاری کرد.
سازمان غذا و داروی آمریکا (افدیای) نیز روند نظارتیاش برای تایید داروی ساختهشده را آسانتر کرد.
دهها پژوهشگر برای ماهها همه کارهای دیگرشان را کنار گذاشتند.
دکتر اورنف در دانشگاه برکلی گفت: «چنین سرعتی در تولید کریسپر (CRISPR)در سطج بالینی برای یک بیماری ژنتیکی در حوزه ما سابقه ندارد. حتی نزدیک به آن هم نیست.»
دیوید لیو از دانشگاه هاروارد، که آزمایشگاه او روش ویرایش ژن مورد استفاده برای اصلاح جهش ژنی این نوزاد را اختراع کرده است، گفت که سرعت کار «حیرتآور» بود. او گفت: «این مراحل به طور معمول نزدیک به یک دهه اگر نه بیشتر طول میکشد.»
دکتر آرنس-نیکلاس تنها زمانی که درمان ویرایشگر ژن در دسترس قرار گرفت و افدیای کار پژوهشگران را تایید کرد، به نزد والدین کیجی رفت.
او گفت: «یکی از وحشتناکترین لحظات زمانی بود که وارد اتاق شدم و به پدرومادر کیجی گفتم: نمیدانم این درمان موثر خواهد بود یا نه، اما قول میدهم هر کاری از دستم بربیاید انجام دهم تا مطمئن شوم که درمانی بیخطر است.»
یک پیروزی برای پژوهشهای زیستپزشکی
صبح روز ۲۵ فوریه (۸ اسفنند) کیجی اولین تزریق وریدی این دارو با مقداری بسیار کم را دریافت کرد، چون هیچ کس نمیدانست او چطور به آن واکنش نشان میدهد. او در اتاقش بود، در گهوارهای که تمام عمرش را در آن گذرانده بود. او ۶ ماهه بود و در صدک هفتم وزنش قرار داشت.
دکتر موسونورو تزریق دو ساعته را زیر نظر داشت و به گفته خودش «هم هیجانزده و هم وحشتزده» بود.
کیجی در طول تزریق خوابید.
در عرض دو هفته، کیجی توانست به اندازه یک نوزاد سالم پروتئین بخورد. اما او هنوز به دارو نیاز داشت تا آمونیاک را از خونش حذف کند - نشانهای از اینکه ویرایشگر ژن هنوز DNA را در همه سلول مبتلا اصلاح نکرده است.
پزشکان ۲۲ روز بعد دوز دوم دارو را به او دادند.
کیجی اکنون به اندازهای حالش خوب است که گروه پزشکی بتوانند رنامهریزی برای ترخیص او از بیمارستان و زندگی در خانه را آغاز کنند و او در حال رسیدن به نقاط عطف رشدی خود است.
پزشکان توانستهاند که مقدار تجویزی دارو را به نصف کاهش دهند. او در این مدت به چند بیماری ویروسی مبتلا شد که معمولاً باعث افزایش شدید میزان آمونیاک خون او میشد. اما او توانست به سلامت این بیماریها را پشت سر بگذارد.
یک هفته و نیم پیش، پزشکان دوز سوم دارو را به کیجی تزریق کردند.
گرچه هنوز خیلی زود است که معلوم شود آیا میتوان تجویز دارو را به طور کامل به کیجی قطع کرد، اما مقدار داروی تجویزی به طور قابلتوجهی کاهش یافته است و حال او به اندازه کافی خوب است که تیم پزشکی بتواند برنامهریزی برای ترخیص او از بیمارستان را آغاز کند. و در حال رسیدن به نقاط عطف رشدی خود است و وزن او اکنون در صدک چهلم برای سنش قرار دارد، اما هنوز مشخص نیست که آیا از پیوند کبد هم معاف خواهد شد یا خیر.
اما دانشمندان همین نتایج را هم یک پیروزی و نتیجه سرمایهگذاری در تحقیقات زیستپزشکی میدانند.
دکتر اورنف گفت: نتیجه «یک پیروزی برای سرمایهگذاری مردم آمریکا در تحقیقات زیستپزشکی است».
پژوهشگران بر نقش بودجه دولتی در توسعه این بیماری تاکید کردند. آنها گفتند که این کار دههها پیش با بودجه دولت فدرال برای پژوهشهای پایه در مورد دستگاه ایمنی باکتریایی آغاز شد. این روند در نهایت با حمایت بیشتر دولت به کشف کریسپر (قیچی مولکولی برای ویرایش ژنها) منجر شد. سرمایهگذاری دولت در تعیین توالی ژنوم انسان، شناسایی جهش کیجی را ممکن ساخت. بودجه دولتی از آزمایشگاه دکتر لیو و کشف ویرایش آن حمایت کرد. یک برنامه دولت فدرال برای مطالعه ویرایش ژن، از تحقیقات دکتر موسونورو حمایت کرد. به موازات آن، یک پژوهش دیگر با سرمایهگذاری دولت بود که منجر به شناخت بیماری کیجی شد.
منبع: نیویورک تایمز
کریسپر چطور ویرایش ژنی را انجام میدهد؟
«کریسپر» در واقع صورت کوتاهشدهای از کلمه CRISPR-Cas9 است. کریسپرها بخشهای تخصصیافتهای از دیانای هستند. پروتئین Cas9 (یا «پروتئین مربوط به کریسپر») آنزیمی است که مانند یک قیچی مولکولی عمل میکند و میتواند زنجیرههای دیانای را قطع کند.
پژوهشگران با استفاده از این فناوری میتوانند به سادگی توالیهای نوکلئوتیدی دیانای (رمزهای ژنتیکی) را تغییر دهند و کارکرد ژنها را عوض کنند. این فناوری کارکردهای بالقوه زیادی دارد، از جمله تصحیح نقایص ژنتیکی، درمان و پیشگیری از انتشار بیماریها و بهبود محصولات کشاورزی. اما کارهایی که با آن انجام میشود، ملاحظات اخلاقی هم ایجاد میکند.
فناوری کریسپر در واقع بر مبنای سازوکارهای دفاعی باکتریها و باستانیان (جانداران تکسلولی) ساخته شده است. این ارگانیسمها از کریسپر و پروتئینهای گوناگون Cas، از جمله Cas9 برای دفاع در برابر حمله ویروسها و سایر عوامل بیگانه استفاده میکنند. این آنزیمها با بریدن و نابود کردن DNA عوامل بیگانه مثلا ویروسها عمل میکنند. هنگامی که این اجزای مولکولی در جانداران پیچیدهتر استفاده شوند میتوان با آنها دستکاری در ژنها یا به اصطلاح «ویرایش» آنها را انجام داد.
ژنومها (مجموعه ژنهای) جانداران گوناگون پیامهای و دستوراتی را برای ساختن پروتئینهای گوناگون رمزبندی میکنند و این رمزها در توالیهای نوکلئوتیدی مولکول دیانای در هسته سلولها قرار دارند. ویرایش ژنها به معنای تغییر دادن این توالیها و در نتیجه تغییر پیامهای است که دارند. این کار با بریدن یا شکستن دیانای و سپس با واداشتن سازوکارهای طبیعی سلول به ترمیم دیانای انجام میگیرد و در این روند است که تغییرات دلخواه در دیانای را میتوان ایجاد کرد. کریسپر ابزاری برای انجام دادن این کار است.
قیچی کردن به این ترتیب انجام میشود که ابتدا یک «آرانای راهنما» (gRNA)، یک زنجیره کوتاه نوکلئوتیدی، به بخشی از دیانای که قرار است اصلاح شود، متصل میشود. سپس «نوکلئاز کَس ۹» (قیچی ژن واقعی) به آرانای راهنما متصل شده و دیانای مورد هدف را برش میدهد.
ترمیم پس از قیچی کردن به دو شیوه میتواند انجام شود:
یک شیوه ترمیم شامل چسباندن دوباره دو سر بریده شده به هم هست. در این چسبانده شدن، معمولا خطاهایی رخ میدهد، یعنی برخی از نوکلئوتیدها (واحدهای سازنده دیانای) به طور تصادفی حذف یا اضافه میشوند، این تغییر که در واقع یک «جهش» یا «موتاسیون» است میتواند یک ژن (بیماریزا) را از کار بیندازد.
در شیوه دوم، شکاف محل بریده شده یا شکستهشده با یک توالی کوتاه نوکلئوتیدی که «قالب» (template) نامیده میشود، پر میشود. دانشمندان میتواند این «قالب» با توجه به هدفشان انتخاب کنند و به این ترتیب ژنی را که میخواهند به DNA اضافه کننند یا یک جهش را تصحیح کنند.